Les cyanobactéries sont parmi les organismes photosynthétiques les plus abondants dans les lacs et les océans. Comme les plantes et les algues, elles convertissent l'énergie solaire en énergie chimique tout en produisant de l'oxygène. Cependant, la lumière devient nocive lorsque l'excitation atteignant les centres réactionnels photosynthétiques excède les capacités de l'organisme à utiliser cette énergie. Pour se protéger d'un tel phénomène, les cyanobactéries convertissent une partie de l'énergie qu'elles collectent sous forme de chaleur.
Cette photoprotection met en jeu un mécanisme moléculaire dont l'élément clé est une protéine soluble photoactive : l'Orange Carotenoid Protein (OCP). L'OCP contient un pigment, le caroténoïde, c'est à dire une molécule capable d'absorber la lumière. L'OCP est une protéine modulaire, composée d'un domaine N terminal et d'un domaine C terminal reliés entre eux par une longue boucle de liaison flexible (linker). La dissipation de l'énergie d'excitation en chaleur est induite par l'activation de l'OCP : dans l'obscurité, l'OCP est sous sa forme orange inactive dans laquelle les deux domaines de la protéine sont en interaction. Sous une forte lumière bleu-vert, l'OCP est activée et convertie dans sa forme rouge active (conformation ouverte) : les interactions inter domaines sont rompues et permettent au domaine N-terminal d'interagir avec le phycobilisome (le complexe collecteur d'énergie lumineuse des cyanobactéries) pour permettre la dissipation de l'énergie d'excitation sous forme de chaleur.
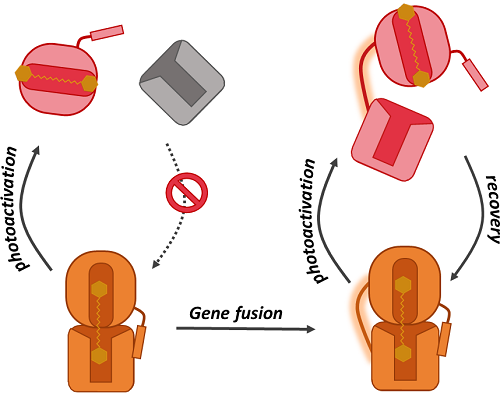
Figure 1 : Le modèle proposé pour l'évolution des OCP est que les domaines ancestraux aient fusionné par addition d'une boucle flexible (linker) qui a permis la mise en place d'un photocycle complet à la place d'une photoactivation irréversible.
Dans cette étude, l'équipe de chercheurs a réalisé l'analyse évolutive et fonctionnelle de la famille des OCPs. Elle a mis en évidence l'existence de trois clades ou groupes monophylétiques, OCP1, OCP2 et OCPX puis a comparé leurs propriétés biochimiques en réalisant pour la première fois une étude fonctionnelle d'OCPX. L'ensemble des résultats obtenus a mis en évidence le rôle clé tenu par le « linker » au cours de l'histoire évolutive des OCPs qui module les interactions inter domaines (Figure 1). Ce travail a de plus permis de proposer un nouveau modèle évolutif où l'OCP ancestrale s'est diversifiée en OCPX et en ancêtre des OCP1 et OCP2, ces dernières s'étant diversifiées dans un second temps (Figure 2).
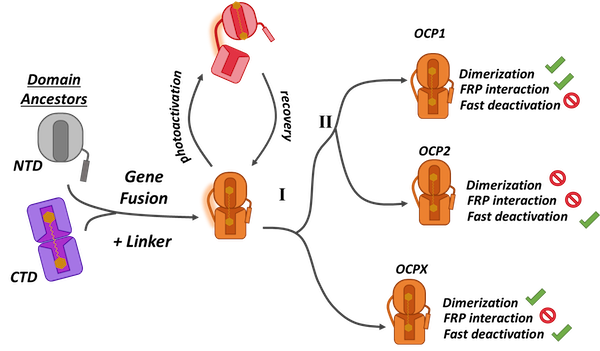
Figure 2 : Après fusion des domaines ancestraux, l'OCP a divergé (I) en OCPX et l'ancêtre des OCP1 et OCP2 qui ont divergé par la suite (II).
La compréhension des déterminants moléculaires qui contrôlent le « photocycle » de l'OCP permettra de concevoir des photoswitchs utilisables en biologie cellulaire (contrôle par la lumière d'enzymes et activités cellulaires ciblées) avec des applications dans la biologie de synthèse et les études in situ.
Texte adapté de l'actualité de l'I2BC du 20 septembre.