La vitesse de vieillissement d’un organisme est contrôlée par un nombre limité de voies de signalisation sensibles aux nutriments (voies mTOR, RAS-PKA) et à l’insuline. Une diminution de l’activité de ces voies expliquerait le ralentissement du vieillissement causé par la restriction calorique. La question est de savoir quels sont les effecteurs de ces voies importantes sur le vieillissement ?
Les peroxiredoxines (Prxs) sont une grande famille d’antioxydants spécifiques des peroxydes, très conservées, récemment découvertes. Les Prxs, dont l’activité catalytique repose sur les propriétés redox du résidu cystéine (Cys), ont intrigué les chercheurs car elles sont inactivées par le substrat peroxyde suite à l’hyperoxydation de leur Cys catalytique, inactivation reversée par l’action réductrice d’une autre enzyme, la sulfiredoxine (Srx), découverte à l’IBITECS. Dans une collaboration antérieure, les 2 équipes avaient montré que chez la levure, la présence de la peroxiredoxine Tsa1 et de Srx était nécessaire pour l’allongement de la durée de vie induite par la restriction calorique.
Dans le présent travail, les auteurs montrent que le rôle de Tsa1 et de Srx1 au cours du vieillissement n’est pas lié à la fonction antioxydante de ce système, mais à une nouvelle fonction de la Prx apparentée à une fonction chaperon. La perte du repliement normal d’une protéine conduit à sa dénaturation et à son agrégation. Dans la cellule, le système chaperon des « Heat Shock Proteins », avec en tête les Hsp70s et la désagrégase Hsp104, est responsable de la réparation des protéines dénaturées, de leur désagrégation, ou de leur ciblage pour dégradation lorsque les dommages sont irréparables. Les chercheurs du SBIGeM et de Göteborg sont partis de l’observation suivante : en l’absence de Tsa1, la reconnaissance et la prise en charge des protéines endommagées par un choc thermique se fait normalement, alors que paradoxalement celle des protéines endommagées par l’H2O2 est complètement défective (Fig. A). Par des approches de microscopie de fluorescence, de biochimie et de génétique, les auteurs ont proposé un modèle selon lequel Tsa1, lorsqu’elle est inactivée par hyperoxydation, est capable de reconnaître les protéines endommagées par l’H2O2, puis de recruter les Hsps. La résolution des agrégats par les Hsps nécessite le recyclage de Tsa1 par Srx1.
Qu’en est-il du vieillissement ? Le vieillissement réplicatif se manifeste par l’accumulation de protéines agrégées dont le rôle dans ce processus est hautement suspecté. Les auteurs ont pu montrer que Tsa1 était nécessaire à la prise en charge des agrégats liés au vieillissement (Fig. B). De plus, la surexpression de Tsa1 diminue le taux d’agrégats protéiques au cours du vieillissement, et cet effet est corrélé à une augmentation majeure de la durée de vie cellulaire (Fig. C).
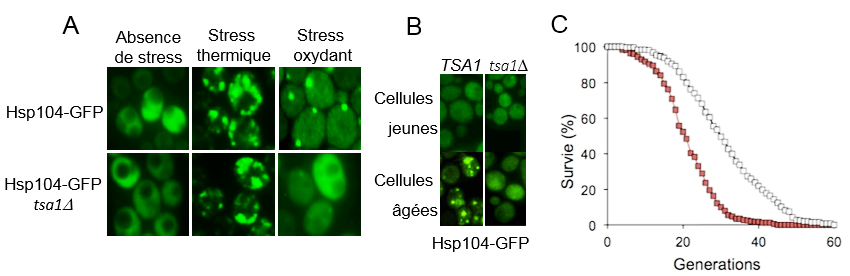
Figure : A. La distribution cellulaire de la
protéine chaperon Hsp104
est homogène en l’absence de stress.
Les stress thermique (42°C)
et oxydant (H2O2) induisent l’apparition d’agrégats
protéiques sur lesquels se concentre Hsp104. En l’absence de la peroxiredoxine
Tsa1 (tsa1D), Hsp104 n’est capable de reconnaitre que les
agrégats induits par le stress thermique, mais pas ceux induits par le stress
oxydant. B. Les cellules âgées, mais non les jeunes, possèdent des
agrégats protéiques témoignant du vieillissement cellulaire. Ces agrégats ne
sont plus reconnus par Hsp104 en l’absence de Tsa1 (tsa1D). C. Les cellules surexprimant la peroxiredoxine
Tsa1 (carrés blancs) ont une durée de vie supérieure de 52%, comparées aux
cellules sauvages (carrés rouges), car elles préviennent l’accumulation
d’agrégats protéiques au cours du vieillissement.
En conclusion, ces travaux confirment l’importance des dommages aux protéines et de leur agrégation au cours du vieillissement. Ils permettent de dire aussi que la reconnaissance et la prise en charge des protéines endommagées par les Hsps nécessitent la peroxiredoxine et son enzyme auxiliaire la sulfiredoxine, tout en apportant une fonction à l’inactivation du pouvoir antioxydant des peroxiredoxines. Ils indiquent aussi une différence moléculaire dans la reconnaissance des agrégats protéiques induits par l’H2O2 et le choc thermique, et suggèrent que ces dommages liés au vieillissement peuvent être assimilés à ceux induits par l’H2O2, ce qui sous-tend la théorie radicalaire du vieillissement cellulaire.
Ce travail a fait l'objet d'un
Communiqué de Presse CEA, diffusé le 03 juin 2016.