La superfamille des cytochromes P450 (CYP), hémoprotéines qui catalysent des réactions de type mono-oxygénation, comprend actuellement des dizaines de milliers de gènes identifiés dans tous les règnes. Son expansion semble jouer un rôle crucial dans l'évolution de la complexité métabolique chez les espèces, en particulier chez les plantes, où les CYP ont évolué et se sont diversifiés en réponse à l'environnement. Les mécanismes de cette diversification restent cependant mal connus. Grâce à des approches combinées de phylogénomique, de bioinformatique structurale, ainsi que biochimiques et génétiques, il a été possible de reconstituer l'histoire évolutive d'un rétroposon de la famille des CYP chez les Brassicaceae.
L'équipe de Saclay a mis à profit son expertise structurale sur les CYP pour interpréter sous forme tri-dimensionnelle les divergences fonctionnelles entre isoformes d'une même sous-famille, les CYP98A. Aucune structure cristalline de cette famille de CYPs végétaux n'étant disponible dans la PDB, il a fallu reconstruire par modélisation comparative toutes les structures nécessaires à cette étude, malgré un bas taux d'identité de séquence (25%) avec les CYP cristallisés disponibles. L'obtention de modèles 3D fiables a été la clé pour la réussite des dockings ultérieurs avec les substrats de type phénolamides ou flavonoïdes, et pour visualiser les interactions moléculaires spécifiques pour chaque paralogue. Cela est rendu possible par l'étonnante conservation du repliement de ces hémoprotéines malgré des séquences très variables, et par le séquençage récent de nombreuses nouvelles espèces de plantes, qui permet l'enrichissement de l'alignement multiple et l'analyse phylogénétique.
L'apport de la modélisation comparative est déterminant chez les plantes, car de nombreuses voies métaboliques sont catalysées par des CYPs, en particulier dans la synthèse de la lignine, biopolymère essentiel du bois. L'histoire évolutive détaillée dans la figure est celle d'un rétroposon apparu chez les Brassicales il y a 70 à 100 millions d'années, avec une nouvelle fonction métabolique permettant la synthèse d'un composant du manteau pollinique et d'un biopolymère formant la paroi des grains de pollen. Dans une seconde étape au cours de l'évolution des Brassicaceae (45 millions d'années), ce rétroposon s'est dupliqué. Les deux gènes frères ont poursuivi leur évolution, l'un acquérant une nouvelle fonction permettant l'élongation de la voie métabolique du pollen. Le sort de ces deux gènes frères a ensuite divergé selon les lignées de Brassicaceae. Chez certaines lignées, un des deux gènes a été perdu, le second remplissant toutes les fonctions métaboliques. Chez une autre lignée, les deux gènes ont été conservés avec un partage complet des fonctions au sein de la voie métabolique. De façon inattendue, la relaxation de la pression de sélection qui résulte de ce partage de fonction, a permis à un gène (98A9) de poursuivre son évolution pour développer une capacité à métaboliser une autre classe de molécules, les flavonoïdes.
Les expériences de docking moléculaire de dérivés de spermidine (voie des phénoliques) et de naringénine (flavonoïde) sur des modèles 3D de paralogues CYP98A8/9 de diverses espèces (dont A. thaliana), ont permis d'identifier un résidu expliquant la diversification fonctionnelle de la famille CYP98 chez les Brassicacées, à savoir l'apparition d'une lysine permettant un ancrage stable de la S-Naringénine chez CYP98A9, et donc une activité naringénine 3'-hydroxylase. Cette simple mutation a suffi à favoriser l'accentuation d'une fonction ancestrale. Cela a été confirmé par des approches génétiques et biochimiques.
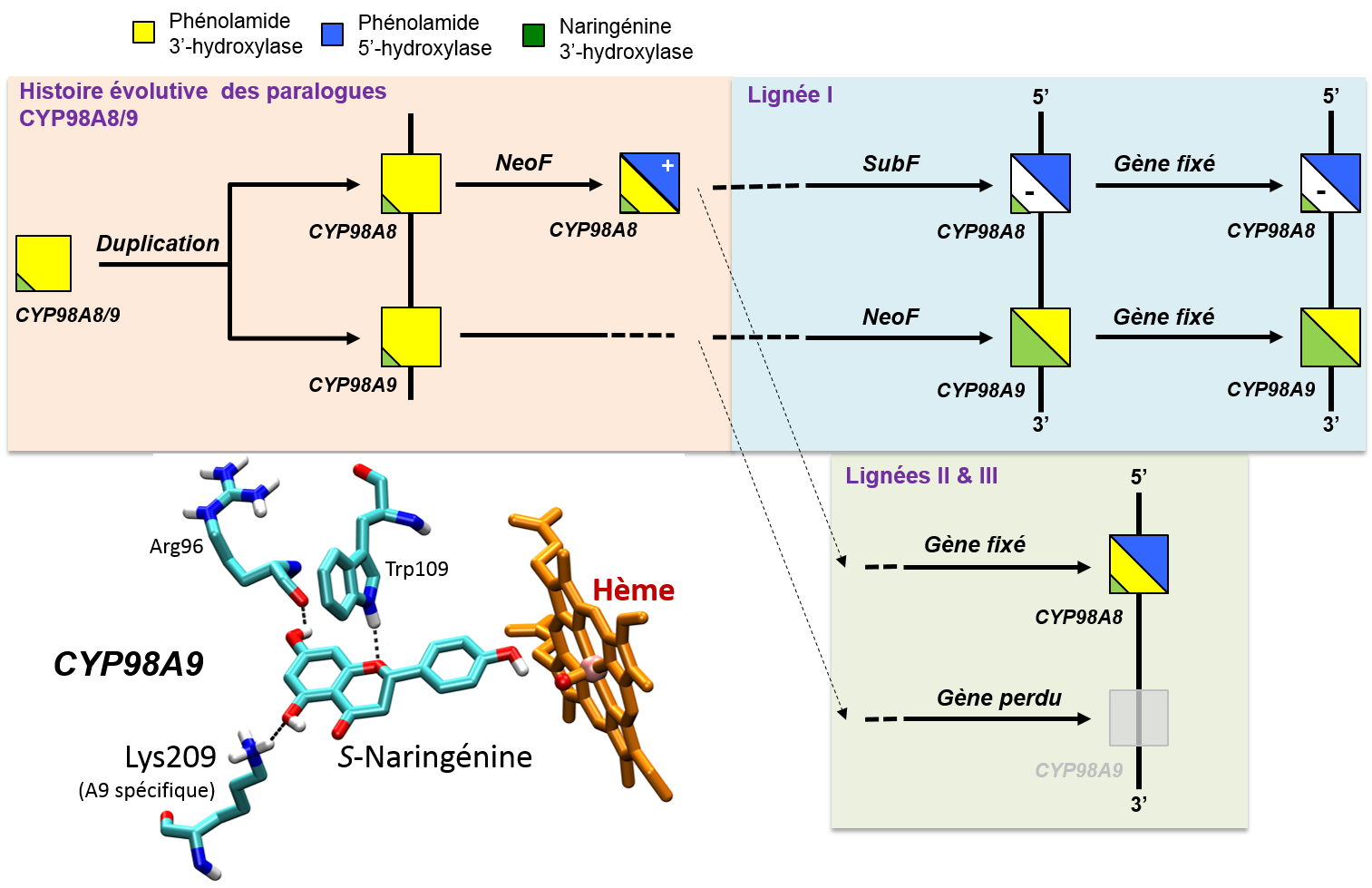
Histoire évolutive d'un cytochrome P450 de plante, le rétroposon du gène CYP98, chez les Brassicaceae.
Le sort des deux paralogues qui résultent de la duplication initiale est illustré dans les lignées I, II et III par des couleurs correspondant aux réactions d'hydroxylation : le jaune et le bleu pour les deux réactions successives d'hydroxylation des phénolamides du pollen, et le vert pour l'hydroxylation de flavonoïdes (naringénine).
Le docking de la S-naringénine sur une structure reconstruite de CYP98A9 d'A. thaliana révèle un résidu clé, la Lysine 209, spécifique de la spécialisation du paralogue A9. La mutation de ce résidu, révélé uniquement par le docking et non détecté par les analyses de pression de sélection sur les codons (taux dN /dS), affecte sélectivement l'activité naringénine 3'-hydroxylase, qui peut être mis en évidence par le retour d'une coloration brune des graines, typique de la synthèse de tannins, polymères de flavonoïdes.
Cette étude réaffirme le caractère stochastique de l'évolution et met en exergue l'importance de la duplication des gènes de CYP dans la plasticité métabolique végétale. Elle montre en outre la précision des outils de modélisation comparative, car, sans disposer d'aucune donnée cristallographique, il a été possible d'identifier un résidu dont la mutation aboutit à une réversion de fonction sur la graine.