La protéine Rad52, déjà connue pour son implication dans la réparation de l'ADN, pourrait constituer une cible de choix dans le traitement de certains cancers du sein et des ovaires. Inactivée, elle conduirait à la mort des cellules tumorales sans compromettre les cellules saines. Mais des données fondamentales sont encore indispensables pour comprendre la fonction précise de Rad52. Une équipe de l'IRCM, qui travaille sur les mécanismes de réparation des lésions de l'ADN, s'est intéressée de près à cette protéine.
Les mécanismes de réparation des lésions de l'ADN sont essentiels à la survie des cellules. Parmi eux, la recombinaison homologue (RH) joue un rôle central dans le maintien de la stabilité des génomes. Ce mécanisme est conservé chez tous les organismes vivants, des bactéries à l'Homme. La protéine clef de ce processus, la recombinase Rad51, forme des oligomères sur l'ADN lésé, à la recherche de séquences d'ADN identiques pour les utiliser comme matrice et assurer une réparation fidèle des lésions. L'équipe d'Eric Coïc, (Laboratoire de Radiobiologie génétique et moléculaire – IRCM) s'intéresse aux mécanismes qui contrôlent et surveillent étroitement la formation correcte des oligomères de Rad51 et la recherche d'homologie. Le laboratoire travaille avec un organisme modèle, la levure de boulanger Saccharomyces cerevisiae, très fréquemment utilisé dans l'étude fine de divers mécanismes biologiques. Le contrôle de la RH est aujourd'hui mieux cerné chez cet organisme, où des acteurs positifs et négatifs ont été identifiés. « Chez la levure, la protéine Rad52 était considérée comme essentielle au recrutement de Rad51 au niveau des lésions, mais son devenir après la formation des oligomères était inconnu jusqu'à présent » explique Eric Coïc. « Or, nos expériences de mutagenèse dirigée montrent que l'interaction entre Rad52 et Rad51 n'est pas indispensable à la formation des oligomères de Rad51. Nous montrons surtout que Rad52 reste associée aux oligomères qu'elle a contribué à former, et participe à leur stabilisation et à leur protection face à l'activité déstabilisatrice d'une autre protéine, Srs2 » ajoute le chercheur. Rad52 est conservée chez l'Homme, mais c'est Brca2 (codée par le gène suppresseur de tumeur BRCA2) qui est principalement impliquée dans le recrutement de Rad51 aux lésions. Rad52 pourrait-elle aussi jouer un rôle dans la formation et la stabilisation des oligomères de Rad51 chez l'Homme ? Peut-être, semble répondre cette étude, mais dans des contextes particuliers qu'il reste à définir.
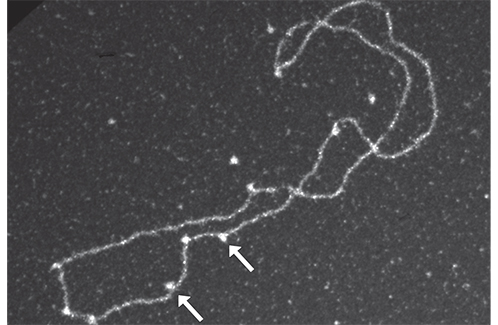
Observation par microscopie électronique : les flèches indiquent des complexes Rad52-Rad51 sur un filament d'ADN.
© ma et al. eLife / IRCM/CEA