La radiothérapie est une arme essentielle pour traiter le cancer. Prescrits dans un cas sur deux, les rayonnements utilisés fragmentent l'ADN des cellules cancéreuses pour les détruire. Cependant, dans la tumeur, certaines cellules peuvent résister au traitement en réparant les cassures de leur ADN et ainsi réduire l'efficacité de la radiothérapie. Inhiber cette capacité de réparation de l'ADN constitue une voie d'amélioration de l'efficacité de la radiothérapie, encore faut-il comprendre en détail les mécanismes de réparation.
Dans les cellules irradiées, un assemblage multi-protéique s'organise autour d'une protéine en forme d'anneau appelée Ku qui encercle très rapidement les extrémités des cassures de l'ADN. Ce ballet de protéines culmine avec, pour final, la soudure entre elles des extrémités des cassures, qui sont ainsi réparées.
Dans cette étude, les chercheurs ont étudié le premier tableau de cette chorégraphie dont Ku est le centre, et en particulier comment entrent en scène APLF et XLF, deux protéines partenaires de Ku. Pour cela, les structures cristallographiques de Ku complexée à de l'ADN et aux motifs de liaison à Ku d'APLF ou de XLF ont été résolues. Les résultats obtenus montrent pour la première fois que chacun des deux partenaires entre en contact avec Ku sur des sites distincts pour initier le processus de réparation (Figure). Les auteurs ont également montré qu'en changeant ces sites par mutation, la machinerie se grippe et la représentation finit en fiasco : la réparation des cassures d'ADN devient défectueuse et les cellules survivent beaucoup moins bien après leur irradiation.
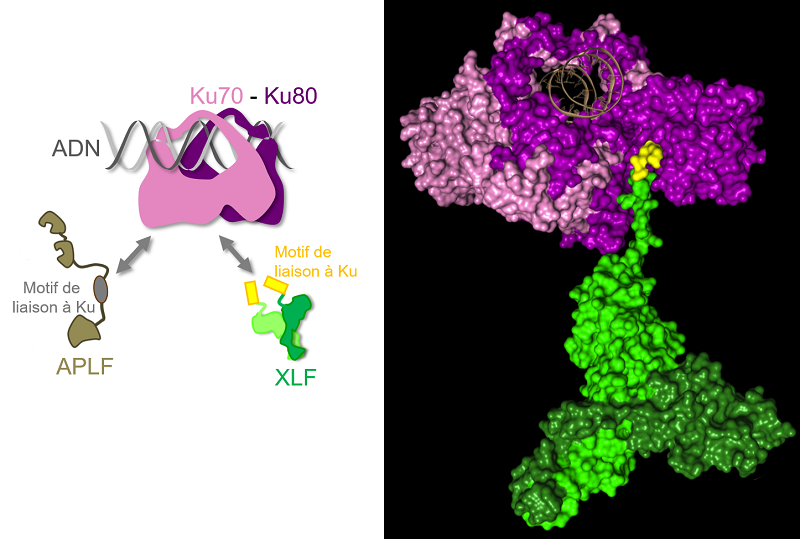
|
Figure : Ku recrute APLF et XLF par deux sites distincts.
À long terme, la connaissance précise des zones de contact entre les acteurs de la réparation des cassures de l'ADN pourrait permettre de concevoir à façon des molécules qui s'ajusteraient parfaitement à ces sites ; en empêchant l'assemblage de la machinerie de réparation dans les tumeurs, ces molécules pourraient les rendre plus sensibles à la radiothérapie.
Ce travail a fait l'objet d'un communiqué de presse le 5 octobre 2018.