Thématiques de recherche : Marquage isotopique & Matériaux
Développement de nouvelles méthodes de marquage au tritium par des nanoparticules de ruthénium et applications en biologie
Le marquage des molécules biologiques par le deutérium et le tritium requiert souvent le recours chronophage et dispendieux à des précurseurs permettant d’introduire plus ou moins efficacement le (radio)isotope sur des positions prédéfinies. Afin de contourner cette difficulté souvent handicapante en biologie mais aussi pour l’innovation thérapeutique, nous nous sommes intéressés au développement de nouvelles méthodes de marquage par échange catalytique H/D et H/T. En collaboration notamment avec l’équipe du Dr. B. Chaudret et du Pr. R. Poteau à l’INSA Toulouse (CNRS/Univ. Paul Sabatier), l'étude de l'échange direct H/D et H/T par des nanoparticules de ruthénium a pu être initiée. Ces dernières présentent la capacité exceptionnelle de catalyse pour l’échange H/D sur divers composés aminés mais aussi soufrés dans des conditions très douces (1-2 atm, 20-55°C) dans différents solvants (organiques ou aqueux). Nos résultats, couplés à des simulations par DFT, indiquent que la réaction met en jeu un mécanisme de C‒H activation énantiospécifique tout à fait nouveau et suggèrent des applications innovantes en termes de fonctionnalisation tardive et économique de molécules organiques. Cette nouvelle stratégie a été appliquée au marquage stéréorétentif de divers composés biologiquement actifs : médicaments, aminoacides, peptides etc… Notre groupe maintient également un savoir-faire en termes de tritiation de molécules d’intérêt biologique par des voies plus classiques et assure diverses collaborations avec des partenaires académiques ou industriels.

La détermination à l’échelle atomique de la structure de petites molécules en interaction avec des assemblages macromoléculaires (auto-assemblages, peptides membranaires, complexes ligands-macromolécule non cristallisés) est un prérequis à la compréhension de leur activité chimique et/ou biologique. Cependant, à l’heure actuelle, il n’existe pas de méthode efficace pour la résolution structurale de tels assemblages non cristallins.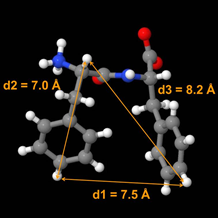 En collaboration avec les Dr. M. Paternostre (CNRS) et T. Charpentier (CEA), nous mettons au point une nouvelle stratégie combinant marquage au tritium, RMN solide du tritium (spin ½) et modélisation moléculaire. Ainsi, nous avons entrepris de déterminer la structure atomique du dipeptide Phe-Phe assemblé en nanotubes qui reste mystérieuse. La preuve de concept, reposant sur la mesure de distances tritium-tritium en RMN solide, a déjà été validée sur des petites molécules rigides et est en passe d’être confirmée sur le modèle dipeptidique cristallisé puisque les distances interatomiques mesurées par RMN sont identiques à celle déterminée par diffraction de rayons X. Cette méthode de cristallographie par RMN du tritium sera appliquée à la résolution structurale des nanotubes de Phe-Phe mais aussi à d’autres nano-objets impliqués dans des processus biologiques (peptides antibactériens, molécules anti-amyloïdes etc…).
En collaboration avec les Dr. M. Paternostre (CNRS) et T. Charpentier (CEA), nous mettons au point une nouvelle stratégie combinant marquage au tritium, RMN solide du tritium (spin ½) et modélisation moléculaire. Ainsi, nous avons entrepris de déterminer la structure atomique du dipeptide Phe-Phe assemblé en nanotubes qui reste mystérieuse. La preuve de concept, reposant sur la mesure de distances tritium-tritium en RMN solide, a déjà été validée sur des petites molécules rigides et est en passe d’être confirmée sur le modèle dipeptidique cristallisé puisque les distances interatomiques mesurées par RMN sont identiques à celle déterminée par diffraction de rayons X. Cette méthode de cristallographie par RMN du tritium sera appliquée à la résolution structurale des nanotubes de Phe-Phe mais aussi à d’autres nano-objets impliqués dans des processus biologiques (peptides antibactériens, molécules anti-amyloïdes etc…).
Collaborations
- CEA : Dr. T. Charpentier, Dr. M. Paternostre, Dr. Y. Boulard
Détermination de structure 3D par mesure
de distances inter-tritiums © SCBM/CEA
Caractérisation de nano-diamants hydrogénés
 Les nanodiamants sont des assemblages carbonés de taille nanométrique dont la réactivité est encore peu connue. De récentes études suggèrent qu’une fois hydrogénés, ils peuvent servir de plateformes pour la conception de nano-catalyseurs pour la chimie mais aussi de nanovecteurs pour le transport ciblé de molécules bioactives (par exemple anticancéreuses). De plus, les propriétés de fluorescence de certains nanodiamants laissent entrevoir des applications très intéressantes en matière d’imagerie diagnostique. Dans le cadre d’une collaboration avec les Dr. T. Charpentier et J-C. Arnault (CEA), nous étudions la réduction de nanodiamants bruts dans un plasma de tritium ou en conditions thermiques sous atmosphère de tritium afin d’élucider leur chimie de surface (position et nombre des fonctions hydrogénées) par RMN solide du tritium.
Les nanodiamants sont des assemblages carbonés de taille nanométrique dont la réactivité est encore peu connue. De récentes études suggèrent qu’une fois hydrogénés, ils peuvent servir de plateformes pour la conception de nano-catalyseurs pour la chimie mais aussi de nanovecteurs pour le transport ciblé de molécules bioactives (par exemple anticancéreuses). De plus, les propriétés de fluorescence de certains nanodiamants laissent entrevoir des applications très intéressantes en matière d’imagerie diagnostique. Dans le cadre d’une collaboration avec les Dr. T. Charpentier et J-C. Arnault (CEA), nous étudions la réduction de nanodiamants bruts dans un plasma de tritium ou en conditions thermiques sous atmosphère de tritium afin d’élucider leur chimie de surface (position et nombre des fonctions hydrogénées) par RMN solide du tritium.
Plasma de tritium généré par micro-ondes
pour la tritiation de nano-diamants.
© SCBM/CEA
Collaborations
- CEA : Dr. J.C. Arnault, Dr. H. Girard, Dr. M. Mermoux, Dr. M. Schlegel
Obtention et étude des propriétés physicochimiques et de la toxicité éventuelle de particules de tungstène tritiées
La mise en œuvre en 2025 du réacteur international ITER (International Thermonuclear Experimental Reactor) implanté à Cadarache pour vérifier la faisabilité scientifique et technique de la fusion thermonucléaire contrôlée comme nouvelle source d’énergie nécessite des recherches complémentaires. En effet, l’abrasion par le plasma des parois en tungstène du Tokamak va produire des particules de tungstène chargées en tritium. La capacité de ces particules à absorber le tritium et à le libérer ensuite demeure incertaine. En collaboration avec les équipes CEA du Dr. V. Mallard et du Dr. C. Grisolia participant au soutien du projet ITER, ainsi que les équipes Universitaires du Dr. D. Vrel (LSPM-Paris 13) et du Dr. G. Dinescu (NILPR-Bucarest) et du Dr. F. Gensdarmes (IRSN), nous avons entrepis d'étudier l’absorption et la libération du tritium gaz par différentes poudres de tungstène produites mécaniquement ou par abrasion laser et d'étudier leur (radio)toxicité sur des cultures de cellules pulmonaires. En absence de particules de référence, cette étude prospective est menée sur divers lots de poussières (30 nm à 3 mm).
Particules de tungstène
© SCBM/CEA
Collaborations
- CEA : Dr. C. Grisolia, Dr. V. Mallard
- Académiques : Dr. D. Vrel (LSPM-Paris 13), Dr. G. Dinescu (NILPR, Bucarest), Dr. F. Gensdarmes (IRSN)
Développement de fluorophores chiraux pour des dispositifs optiques / photoniques
La découverte et le développement de nouvelles molécules ayant des propriétés de fluorescence retardée (aussi appelées molécules TADF pour Thermally Activated Delayed Fluorescence) et d'émission de lumière circulairement polarisée (ou CPL pour Circularly Polarized Luminesce) est cruciale pour l'émergence de nouveaux dispositifs optiques de haute performance. La fluorescence retardée confère aux molécules la propriété de récupérer à la fois les excitons singulets et triplets pour l'émission de lumière via un croisement inter-système inverse résultant d'une faible différence énergétique entre les états singulets et triplets de la molécule. Récemment, de nombreux groupes de recherche se sont intéressés à cette propriété, notamment pour le développement de diodes électroluminescentes organiques (OLED) possédant de très bonnes efficacités. Par ailleurs, la conception de petites molécules organiques (SOM pour Small Organic Molecules) possédant des propriétés d'émission de lumière circulairement polarisée est un challenge pour les chimistes organiciens. En effet, seul un nombre limité de petites molécules organiques possèdent ce type de propriété avec un haut facteur de dissymétrie (glum) tout en conservant un rendement quantique (φF) exploitable. De plus, ces molécules chirales sont, d'une manière générale, obtenues après de nombreuses étapes de synthèse et nécessitent une séparation via HPLC chirale restreignant les possibilités d'applications. De ce fait, un accès rapide, facile et modulable à de nouvelles molécules possédant des propriétés TADF et CPL est primordial pour exploiter leur potentiel technologique.
Notre équipe a commencé à travailler sur cette thématique en 2015 et étudie actuellement la relation entre la structure et les propriétés afin d'améliorer les propriétés d'émission de lumière circulairement polarisée.