Notre équipe s'intéresse plus particulièrement aux processus d'assemblage des centres fer-soufre (Fe-S) qui sont des groupements prosthétiques de protéines (Fig. 1) intervenant dans une multitude de processus biologiques essentiels : synthèse d'ATP, synthèse protéique, régulation de l'expression des gènes…
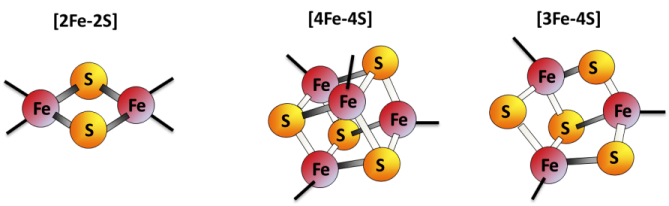
Figure 1: les différents types de centres fer-soufre
Les centres Fe-S sont synthétisés par différentes machineries multi-protéiques présentent dans la mitochondrie et dans le cytosol (Fig. 2). Les persulfures dédiés à la synthèse des centres Fe-S sont générés dans la mitochondrie et utilisés comme réservoir d'ions sulfures (S2-) mobilisables par réduction de la liaison disulfure. La synthèse des centres Fe-S est donc intimement liée au métabolisme redox et notamment au système GSH/GSSG qui pourrait intervenir dans le transport de soufre via persulfures. Nos études combinent des approches biochimiques (reconstitution in vitro des machineries d'assemblage, analyses spectroscopiques) et des approches cellulaires (protéomiques, métabolomiques) et génétiques dans des contextes de défaut de synthèse des centres Fe-S. Nous développons également des techniques d'analyses permettant de déterminer l'état redox et l'état de coordination des résidus cystéines afin d'étudier in cellulo les processus de transfert de soufre et d'assemblage des centres Fe-S.
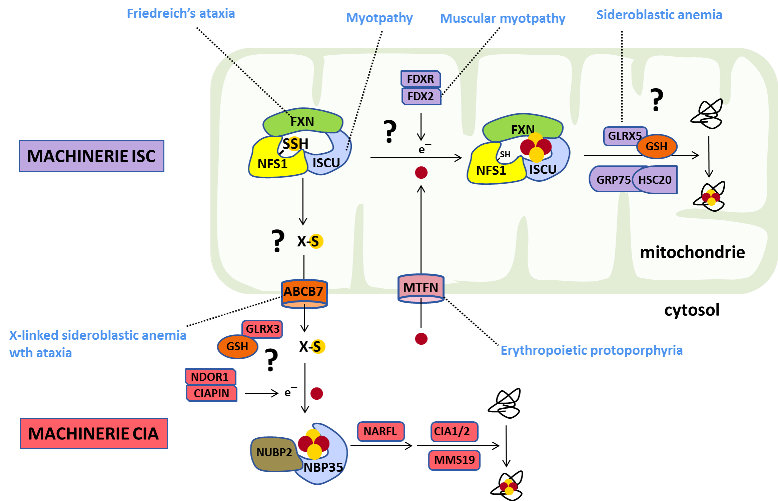
Figure 2: Mécanismes de biogenèse des centres Fe-S chez les mammifères et maladies humaines associées.
Différents aspects des processus d'assemblage sont étudiés :
- Nous étudions les étapes primaires mitochondriales de synthèse des centres Fe-S, en cherchant à caractériser les fonctions moléculaires des différents acteurs de ce processus : ISCU, NFS1, ferredoxine 2, système GSH/glutarédoxine 5…
- Nous cherchons à comprendre comment le soufre est transporté entre la mitochondrie et le cytosol : par quelle(s) protéine(s) ou métabolite(s) et sous quelle forme chimique. Nous avons montré que le GSH est un composant essentiel de la biogenèse des centres Fe-S cytosoliques chez la levure S. cerevisiae suggérant qu'il pourrait être impliqué dans ce processus d'export. Nous cherchons également à mieux comprendre comment la compartimentation du GSH entre cytosol et mitochondrie influe sur le processus de biogenèse.
- Nous avons récemment montré qu'une protéine mitochondriale, la frataxine (FXN), joue un rôle central dans le processus globale de synthèse des centres Fe-S en stimulant des réactions de transfert de soufre via l'intermédiaire persulfure de NFS1. Nous cherchons à mieux comprendre comment le transfert de soufre est régulé, notamment quels sont les stimuli cellulaires auxquelles répondent la frataxine: demande en centres Fe-S, inflammation, stress oxydant, surcharge/déficience en fer ?