La chlorelle est une algue verte unicellulaire d'eau douce faisant partie des quelques microalgues cultivées industriellement et candidates pour la production de molécules carbonées riches en énergie. Des chercheurs du CEA, du CNRS, de l’ESRF, de l’Inserm, et des Universités Aix-Marseille, Grenoble Alpes et Paris-Sud ont découvert chez cette microalgue une enzyme qui lui permet de transformer certains de ses acides gras en hydrocarbures à l’aide de la seule énergie lumineuse. « C’est une avancée majeure dans l’identification de mécanismes du vivant permettant la conversion des acides gras des cellules en hydrocarbures et cela ouvre une nouvelle voie en vue de la synthèse d’hydrocarbures par des micro-organismes à une échelle industrielle », précisent les auteurs.
Dans cette étude publiée par Science, les chercheurs de l’Institut de biosciences et biotechnologies d’Aix-Marseille (CEA/CNRS/Aix-Marseille Université), ont pu identifier cette enzyme clef pour la synthèse d’hydrocarbures2 en la traçant grâce à son activité puis en déterminant une liste de candidats possibles grâce à une analyse protéomique3 réalisée au laboratoire Biologie à grande échelle (CEA/Inserm/Université Grenoble Alpes). L’expression dans la bactérie E. coli du gène codant pour la principale de ces enzymes candidates a mis en évidence la production d’hydrocarbures, démontrant que cette enzyme était nécessaire et suffisante pour synthétiser des hydrocarbures. La caractérisation de l’enzyme pure a révélé qu’elle était capable de couper un acide gras en une molécule d’hydrocarbure et une molécule de CO2 et que cette activité nécessitait de la lumière (Figure 1).
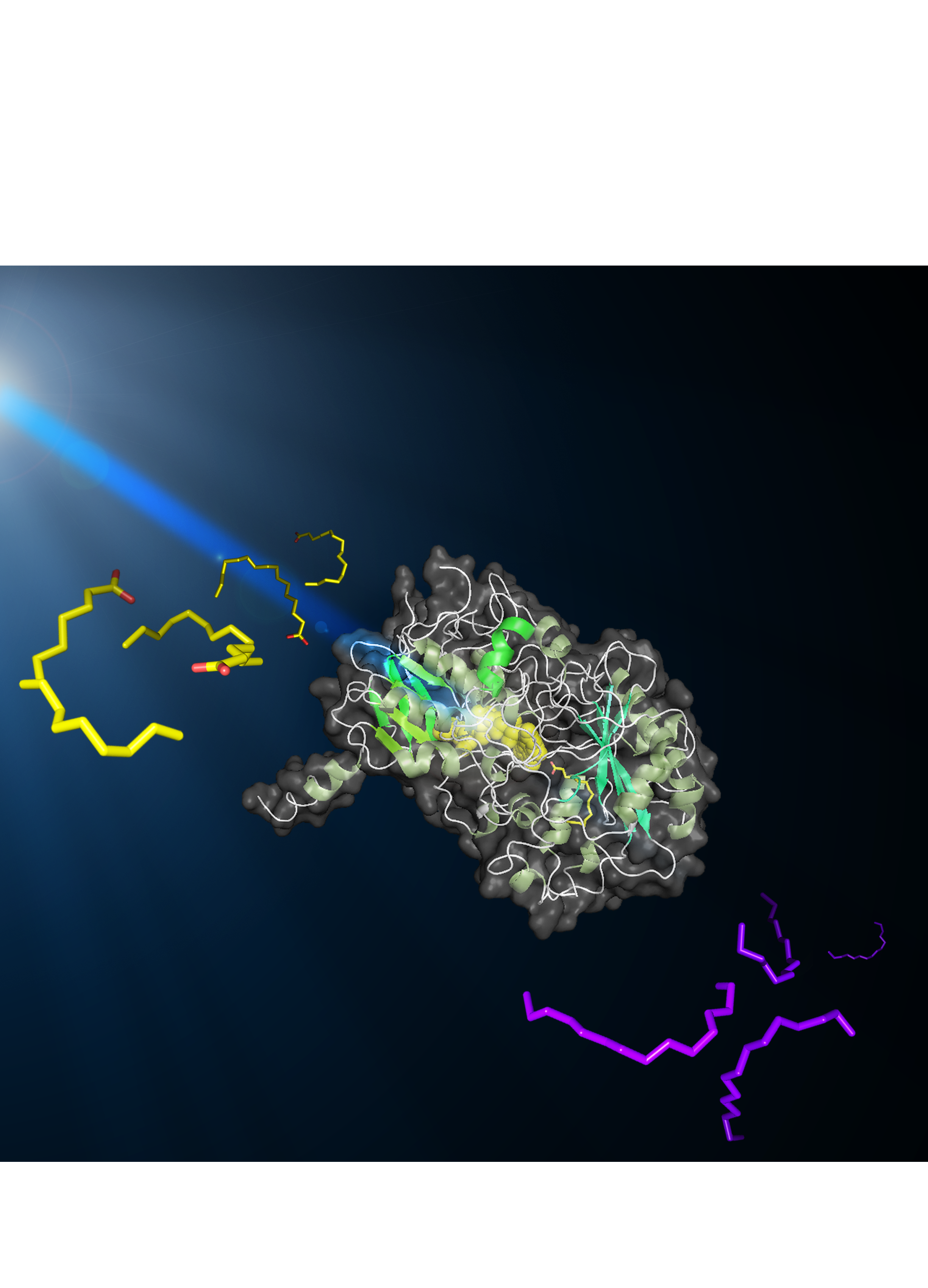
Vue stylisée d’une molécule de FAP convertissant des acide gras en hydrocarbures sous l’effet de la lumière bleue. La FAP est au centre. A sa gauche en jaune: molécules d’acides gras ; à sa droite en mauve : molécules d’hydrocarbures. © Caroline EPLE
Les chercheurs ont aussi montré qu’un cofacteur présent dans l’enzyme permettait de capter la lumière bleue. La structure tridimensionnelle de l’enzyme (Figure 2), déterminée par une étude de diffraction aux rayons X menée sur la ligne de lumière entièrement automatisée « MASSIF-1 » au synchrotron européen (ESRF, Grenoble), et des études de spectroscopie d’absorption cinétique, réalisées à l’Institut de biologie intégrative de la cellule (CEA/CNRS/Université Paris-Sud), ont permis de proposer un modèle du mécanisme de l’enzyme. L’acide gras est positionné dans un tunnel hydrophobe au bout duquel se trouve le cofacteur. Ce dernier, lorsqu’il est excité par la lumière bleue, vient arracher un électron au groupement carboxyle de l’acide gras, ce qui provoque la décarboxylation spontanée en une molécule d’hydrocarbure.
Figure 1. Schéma de la réaction catalysée par la FAP. Elle convertit en une seule étape un acide gras en hydrocarbure en enlevant le groupement carboxyle de la chaîne carbonée (réaction de décarboxylation). Sans lumière, l’enzyme est inactive.
1 De l’Institut de Biosciences et Biotechnologies d’Aix-Marseille (BIAM à Cadarache ; CEA/CNRS/Aix-Marseille Université), en collaboration avec l’Institut de Biologie Intégrative de la Cellule (I2BC à Saclay ; CEA/CNRS/Université Paris-Sud), le laboratoire Biologie à Grande Echelle (BGE à Grenoble ; CEA/INSERM/Université Grenoble Alpes) et le Synchroton Européen de Grenoble (ESRF), et avec le soutien de la région PACA.
2 Ici, des alcanes et des alcènes, les premiers étant des hydrocarbures dont la chaine carbonée est entièrement saturée d'hydrogène, alors que les seconds ont des insaturations (i.e. des doubles liaisons C=C).
3 La protéomique étudie les protéines et donne accès à l’expression génique d’une cellule, d’un tissu ou d’un organe, grâce à l'étude des protéines et de leurs modifications post-traductionnelles.
4 Un cofacteur est une molécule non protéique qui est liée à l’enzyme et est nécessaire à son activité. Ici le cofacteur est un dérivé de la flavine, une petite molécule organique qui absorbe la lumière bleue et est par ailleurs un composant de la vitamine B2.
5 Ce sont une enzyme de réparation de l’ADN, une enzyme de synthèse de la chlorophylle et les centres réactionnels des deux photosystèmes permettant de réaliser la photosynthèse chez les plantes et les algues.
La découverte de cette enzyme baptisée FAP (acronyme anglais pour acide gras photo-décarboxylase) revêt un grand intérêt d’un point de vue fondamental car à ce jour, seulement quatre biocatalyseurs capables d’utiliser l’énergie lumineuse (photoenzymes) ont été découverts . La FAP est au moins dix fois plus rapide que la meilleure enzyme de synthèse d’hydrocarbures connue et utilise la lumière, ce qui pourrait en faire un outil biotechnologique très efficace pour la synthèse d’hydrocarbures, soit par conversion in vitro d’huiles, soit par conversion in vivo des acides gras membranaires de bactéries, levures ou idéalement microalgues.
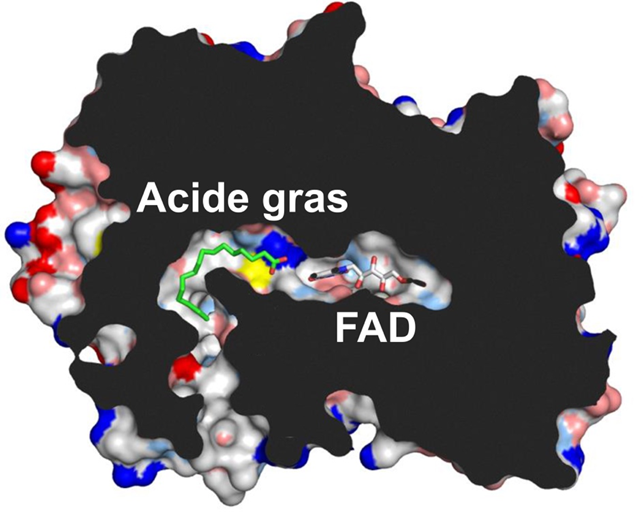
Figure 2. Coupe à travers la structure tridimensionnelle de la FAP. Le cofacteur dérivé de la flavine (FAD) est situé au fond d’un tunnel hydrophobe où se fixe l’acide gras (en vert). Le plan de coupe est indiqué en noir. © CEA-Biam/Pascal Arnoux. © CEA-Biam/Pascal Arnoux
Du carburant fossile au carburant « bio »

Microalgues (chlorelle) vues au microscope. © VladiDamian
Les hydrocarbures sont actuellement essentiellement tirés du pétrole mais les plus accessibles de ces réserves fossiles s’épuisent progressivement tandis que l’extraction des pétroles non conventionnels est de plus en plus coûteuse d’un point de vue environnemental.
Une production bio-sourcée d’hydrocarbures utiliserait comme source de carbone le CO2 atmosphérique et permettrait de limiter le rejet massif dans l’atmosphère de carbone stocké dans le sous-sol. De plus, les hydrocarbures sont difficilement remplaçables dans la chimie et comme carburants dans l’aéronautique. Dans une optique de limitation de l’utilisation des carburants fossiles, la production d’hydrocarbures à partir du vivant est donc un objectif important des biotechnologies.