Les 2,5-dicétopipérazines (2,5-DKP), produites par les champignons, les bactéries, les plantes et les animaux, possèdent des propriétés biologiques remarquables (antibactériennes, antivirales, anticancéreuses ou anti-inflammatoires) qui les rendent très attractives pour la pharmacopée. L'équipe de Muriel Gondry (I2BC/SBIGeM) étudie depuis plusieurs années les voies bactériennes de biosynthèse de ces molécules. Celles-ci sont synthétisées en plusieurs étapes : dans un premier temps, les synthases de cyclodipeptides (CDPS), découvertes en 2009 par l'équipe, fabriquent, à partir des acides aminés chargés sur les ARN de transfert (AA-ARNt), des cyclodipeptides, qui sont ensuite modifiés par d'autres enzymes pour former des 2,5-DKP.
Malgré un faible niveau d'identité de séquence et l'existence de deux sous-familles de CDPS, ces enzymes semblent toutes utiliser un mécanisme similaire, reposant sur la liaison successive de deux substrats AA-ARNt et la formation d'intermédiaires successifs aminoacyl-enzyme et dipeptidyl-enzyme. Pour chacun des deux substrats AA-ARNt, on ne connaît pas la partie de l'ARNt reconnue par les CDPS, même si certaines études suggèrent qu'il s'agit de son bras accepteur. C'est cette hypothèse que les chercheurs ont voulu tester dans la présente étude.
Pour cela, ils ont tiré profit de la technologie des flexizymes, développée par une équipe japonaise. Les flexizymes sont des ribozymes (ARN possédant une activité de type enzymatique), capables d'aminoacyler une grande variété d'ARN. Grâce à cette technologie qu'ils ont mise en place et adaptée au laboratoire, les chercheurs ont produit et purifié différents AA-ARNt raccourcis qu'ils ont ensuite testés in vitro pour leur capacité à être des substrats d'une CDPS. Ils ont ainsi observé que les molécules mimant le bras accepteur des ARNt (AA-microHx) (figure) sont des substrats aussi efficaces que les AA-ARNt, démontrant que les bras accepteurs des ANRt sont les seules parties nécessaires pour l'activité des CDPS.
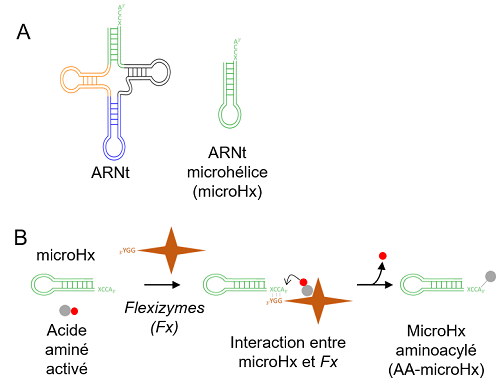
A : gauche, schéma d'un ARNt avec le bras accepteur figuré en vert ; droite, schéma de l'ARNt raccourci mimant le bras accepteur de l'ARNt (microHx). B : microHx est aminoacylé par les flexizymes pour former AA-microHX dont la présente étude démontre qu'il est un substrat des CDPS. © N.Canu/CEA
La méthode développée dans cette étude pourra être utilisée pour l'étude mécanistique d'autres enzymes ayant pour substrat des AA-ARNt. Elle devrait aussi permettre l'incorporation dans des cyclopeptides d'analogues non-naturels d'acides aminés via la synthèse par les flexizymes d'ARNt ou de micro-Hx chargés avec ces analogues qui seront alors testés comme substrats des CDPS.
Voir également à ce sujet le fil ScoopIt du département SDV de l'UPSay : http://sco.lt/77PYhM et
l'actualité du département de Microbiologie de l'I2BC : https://www.i2bc.paris-saclay.fr/spip.php?article1449