Le paludisme, une maladie provoquée par des parasites du genre Plasmodium, est un problème de santé mondial dont la mortalité demeure très élevée, spécialement chez les enfants. Selon l'OMS, cette maladie est responsable de près d'un million de décès par an dans le monde. Environ 40% de la population mondiale est exposée et 500 millions de cas cliniques sont observés chaque année. Les traitements actuels pourraient devenir moins efficaces, voire inefficaces, en raison du développement et de la propagation rapide, chez plusieurs espèces de Plasmodium, de souches pharmaco résistantes aux anti-paludéens classiquement utilisés. Il est donc urgent d'identifier de nouvelles cibles thérapeutiques afin de développer de nouveaux traitements.
Des travaux récents, basés sur des approches de « gene targeting », ont révélé que des transporteurs de la famille des P4-ATPases sont des candidats potentiels pour le ciblage de médicaments en raison de leur rôle essentiel chez le parasite. Les ATPases de type P4, aussi appelées flippases, sont des protéines de transport membranaire de lipides qui participent au maintien d'une asymétrie lipidique entre les deux « couches » des membranes cellulaires.
Dans ce travail, les chercheurs ont choisi d'étudier ATP2, une flippase de Plasmodium dont la fonction n'a encore jamais été caractérisée et qui est une cible potentielle de deux médicaments antipaludiques. Pour cela, ils ont utilisé une ATP2 recombinante de Plasmodium chabaudi, PcATP2, produite chez la levure S. cerevisiae. Ils ont montré que PcATP2 forme des hétérodimères avec deux des trois sous-unités Cdc50 présentes dans le génome du parasite (les protéines Cdc50 sont des partenaires indispensables des P4-ATPases, responsables de l'adressage du complexe au bon emplacement membranaire et de son activité fonctionnelle). Des tests d'activité ATPasique ont identifié deux substrats physiologiques potentiels de PcATP2 : la phosphatidylsérine et la phosphatidyléthanolamine, et ont montré une régulation positive par le phosphatidylinositol 4-phosphate, un lipide connu pour son rôle indispensable au cours du développement intra-érythrocytaire de Plasmodium falciparum.
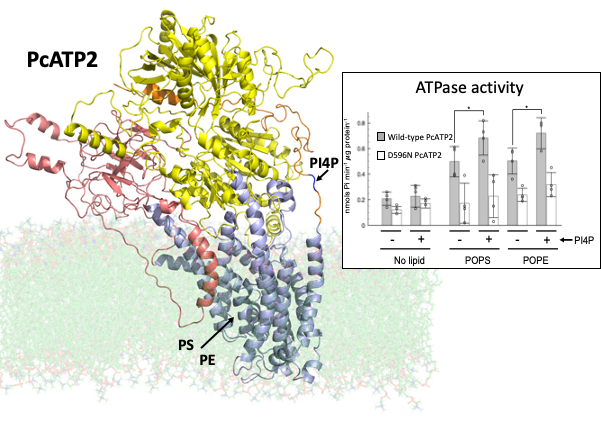
Modèle structurel 3D de PcATP2 basé sur les structures Cryo-EM des flippases de levure et humaine, Drs2p et ATP8A1, respectivement. Le modèle structurel 3D est intégré dans une membrane (représentée en vert pâle). Les domaines cytoplasmiques impliqués dans la liaison à l'ATP et l'autophosphorylation sont en jaune, et le domaine cytoplasmique impliqué dans la déphosphorylation de la protéine en rouge. L'extrémité C-terminale potentiellement impliquée dans l'auto-inhibition de la protéine est représentée en orange. Les flèches indiquent la position de la poche de liaison du substrat prédite des phospholipides phosphatidylsérine (PS) et phosphatidyléthanolamine (PE), ainsi que la région de liaison putative du PI4P. ©JL Vazquez-Ibar/CNRS
Il s'agit de la première caractérisation biochimique d'une flippase de Plasmodium, donc d'un premier pas vers la compréhension du rôle physiologique essentiel de ce transporteur et vers sa validation comme cible potentielle de médicaments antipaludiques.
Contact : jose-luis.vazquez-ibar@i2bc.paris-saclay.fr
Texte adapté du Scoop.It du département SDV de l'UPSay du 26 janvier 2021.