Il y a une dizaine d'années, une équipe de l'IPMC* découvrait dans le venin du mamba noir la Mambalgine-1 (Mamb-1), un peptide analgésique chez les rongeurs, aussi puissant que la morphine, présentant moins d'effets secondaires indésirables, dont le mode d'action, indépendant des opioïdes, implique l'inhibition spécifique des ASIC (Acid-Sensing Ion Channels). Les ASIC sont des canaux neuronaux cationiques indépendants du potentiel qui conduisent principalement les ions Na+ et sont activés par l'acidification extracellulaire et les lipides. Largement exprimés dans les systèmes nerveux périphérique et central, et impliqués, entre autres, dans les processus de nociception et de plasticité neuronale, ils constituent des cibles intéressantes pour des applications cliniques dans les domaines de la douleur, de la psychiatrie, des maladies neurodégénératives et du cancer.
Depuis la découverte de la Mamb-1, l'équipe de l'IPMC collabore avec le SIMoS (DMTS) pour élucider son mode d'action. En effet, comprendre en détail comment la Mamb-1 inhibe les canaux ASIC des mammifères permettra de développer des bloqueurs optimisés de ces canaux. De nombreuses études, incluant la résolution récente par cryo-EM à basse résolution de complexes ASIC1-Mamb-1, ont montré que la Mamb-1 inhibe le canal ASIC1 (humain ou de poulet), en se liant préférentiellement, du côté extracellulaire, à l'état fermé de ce canal, qu'elle stabilise. De façon intéressante, ces structures, même si elles n'offrent pas de description détaillée de l'interaction entre le peptide et le canal, contredisent le modèle proposé par ces équipes en 2016 (cf Fait Marquant), selon lequel la Mamb-1 lierait profondément la poche sensible au pH du canal.
Dans ce contexte, les chercheurs de l'IPMC et du SIMoS ont tiré profit de la publication récente de la structure cristallographique de l'état fermé de l'ASIC1 de poulet pour modéliser l'interaction entre le canal ASIC1 de rat et la Mamb-1, dont la structure 3D a été résolue par ces équipes en 2016. Pour cela, ils ont synthétisé par voie chimique différents variants de la Mamb-1 et étudié leur interaction avec des variants du canal ASIC1 de rat. L'analyse des résultats obtenus permet d'identifier des paires de résidus de la Mamb-1 et du canal potentiellement en interaction, qui sont utilisées pour modéliser, par dynamique moléculaire, le complexe de la Mamb-1 avec le canal ASIC1 de rat dans son état fermé. L'image détaillée des interactions ainsi obtenue (Figure), compatible avec la structure obtenue par cryo-EM basse résolution du complexe Mamb-1/ASIC1 humain, permet de proposer que la Mamb-1 n'agit pas directement avec le capteur de pH du canal mais verrouille par plusieurs contacts une charnière clé entre les hélices α4 et α5 d'un domaine extracellulaire de l'ASIC1 pour empêcher l'ouverture du canal.
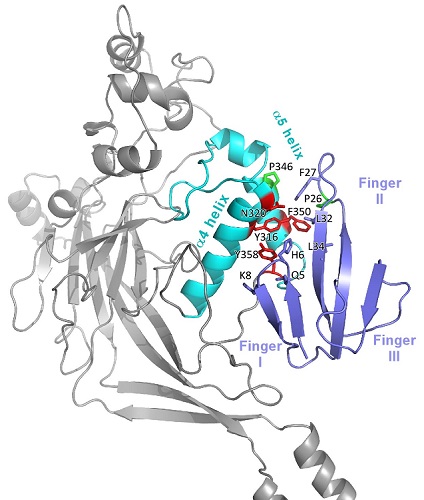
Modèle structural du complexe Mamb-1-ASIC1a.
Zoom sur la région d'interaction impliquant les hélices α4 et α5 du canal ASIC (en cyan) et les doigts 1 et 2 de la Mambalgine-1 (en bleu-violet). Les résidus majeurs dans cette interaction sont figurés.
En conclusion, ces résultats fournissent un modèle amélioré d'inhibition des canaux ASIC1 de mammifères par la Mamb-1 et des indices pour le développement ultérieur de bloqueurs ASIC optimisés.
Contact : Denis Servent
* IPMC : Institut de Pharmacologie Moléculaire et Cellulaire, UMR7275, Université Côte d'Azur, CNRS.