Les tumeurs sont composées de cellules qui prolifèrent excessivement et échappent à la mort cellulaire programmée (apoptose). Une manière d'induire la mort d'une cellule tumorale est de suffisamment casser son ADN. C'est ce qui est fait en radiothérapie et avec certaines chimiothérapies. Mais les cellules tumorales qui n’auraient pas été éliminées sont capables de réparer les cassures de leur ADN et peuvent donc à nouveau proliférer. Une stratégie complémentaire consiste donc à agir sur les mécanismes de réparation de l'ADN.
Les cellules humaines réparent leur ADN de deux manières différentes :
- en liguant les extrémités cassées, c'est le système de jonction des extrémités non-homologues (NHEJ en anglais),
- en recopiant la séquence homologue portée par une chromatide sœur, c'est le système de recombinaison homologue.
La voie NHEJ est le système de réparation dominant. Après une radiothérapie, les cellules tumorales ont absolument besoin de cette voie de réparation, contrairement aux cellules normales. NHEJ est initié par le complexe protéique Ku70/Ku80 qui encercle très rapidement les extrémités de la cassure et sert d'amarre pour les autres protéines nécessaires à ressouder entre elles ces extrémités, DNA-PKc, Lig4, XRCC4 et XLF. Le système NHEJ est très régulé : cofacteurs, modifications post-traductionnelles, métabolites…
Il y a une vingtaine d'années, des scientifiques ont découvert qu'une petite molécule produite par le corps et parfois utilisée comme complément alimentaire, l'inositol-hexaphosphate (IP6) ou acide phytique se lie au complexe Ku et stimule NHEJ.
Par deux techniques d'étude des protéines à l'échelle atomique (cristallographie et cryo-microscopie électronique), des chercheurs de l'I2BC (département B3S / équipe
INTGEN, (UMR 9198, CNRS/CEA/UPSaclay, Gif-sur-Yvette), de l'IPBS (CNRS/Université Paul Sabatier) et de l'Institute for Structural and Chemical Biology (Leicester) ont découvert comment IP6 se lie à la protéine Ku. Des expériences de biophysique montrent que la liaison d'IP6 à Ku stabilise l'interaction de Ku avec l'ADN et augmente l'affinité pour Ku de la protéine XLF.
In vitro, dans des cultures cellulaires, des mutations du site de liaison d'IP6 à Ku réduisent l'accumulation de Ku sur les sites de cassure et le recrutement d'XLF sur ces mêmes sites, réduisant de fait l'efficacité du système. Autrement dit, la présence de l'acide phytique sur la protéine Ku stimule l'accrochage sur cette dernière de la protéine XLF, étape essentielle pour souder efficacement la cassure de l'ADN (voir Figure). Ce travail ouvre des perspectives thérapeutiques en identifiant une nouvelle zone sur la protéine Ku qui pourrait être ciblée par des petites molécules afin de bloquer la réparation des cassures dans les cellules tumorales.
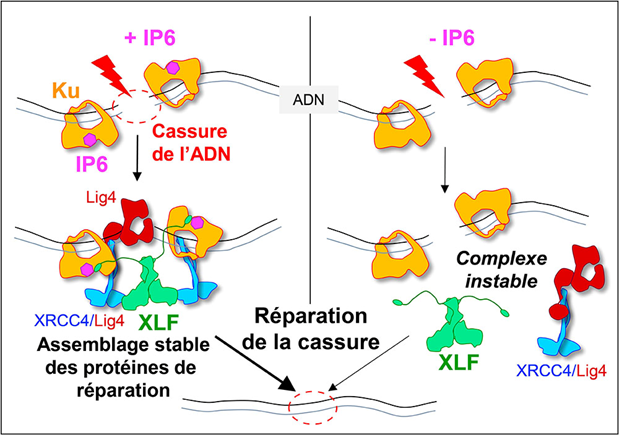
Lorsqu’une cassure des deux brins de l’ADN est induite, par exemple au cours d’une séance de radiothérapie, elle est immédiatement reconnue par la protéine Ku qui sert de site d’ancrage pour les autres protéines responsables de la soudure des extrémités : l’ADN ligase 4 (Lig4), XRCC4 et XLF. La stabilité de ce large complexe de protéines dépend de la liaison d’une petite molécule, l’IP6, sur Ku. Lorsque l’IP6 est absent (à droite sur le modèle), XLF se lie moins bien à Ku, l’assemblage est instable et la réparation des cassures est moins efficace. © Ph. Frit / IPBS
Contact Institut des sciences du vivant Frédéric-Joliot :