La caractérisation pharmacologique des interactions entre les différents peptides (toxines animales, hormones...) ou petites molécules (phycotoxines) étudiés au laboratoire et leurs cibles moléculaires respectives est réalisée à l'aide d'expériences in vitro, ex vivo et in vivo. Ces études sont cruciales pour la compréhension du mode d'action de ces molécules et pour évaluer leur potentiel de développement en tant que médicaments innovants en fonction de leur profil pharmacologique.
1 - Expériences de liaison (récepteurs couplés aux protéines G (GPCRs), récepteurs nicotiniques de l'acétylcholine (nAChRs), canaux ioniques)
Notre capacité à marquer (125I, 3H, 14C) et à utiliser des molécules radioactives nous permet de réaliser des essais de liaison pour caractériser les paramètres fondamentaux des interactions toxine/cible par des expériences de cinétique (Kon, Koff), de saturation (KD, Bmax) ou de compétition (IC50, Ki). En outre, les essais de liaison permettent d'étudier le mode d'action (antagonisme compétitif/non compétitif, allostérie) et de déterminer le profil pharmacologique (sélectivité de sous-type et d'espèce) des composés étudiés (Blanchet et al., 2017; Petrel et al., 2013).
2 - caractÉrisation fonctionnelle
Pour l'étude fonctionnelle des ligands interagissant avec les GPCRs et la caractérisation de leur mode d'action (agoniste/inverse agoniste/antagoniste/allostérique), plusieurs techniques sont mises en œuvre au laboratoire, la plupart basées sur des techniques de mesure de fluorescence/luminescence. Deux lecteurs de microplaques dédiés sont disponibles (BMG Labtech Clariostar et Perkin Elmer Envision Xcite) permettant de mesurer la fluorescence, le FRET, le FRET résolu dans le temps, le BRET ou la luminescence dans des plaques de 96 et 384 puits.
Les seconds messagers, AMPc et inisitol-phosphate (IP-1), ainsi que l'activation des kinases en aval telles que les MAP kinases ERK1/2, sont quantifiés par TR-FRET à l'aide de kits hTRF commerciaux. La modulation de la concentration intracellulaire de Ca2+ est suivie au moyen de sondes fluorescentes sensibles au calcium (Fluo3, Fluo4 ...), tandis que le recrutement des beta-arrestines par les GPCRs est quantifié par la technique BRET, en utilisant des récepteurs marqués au YFP et des beta-arrestines marquées à la luciférase.
Enfin, l'oligomérisation des récepteurs est étudiée soit par TR-FRET en utilisant des récepteurs marqués par SnapTAG avec des cryptates de terbium et des accepteurs de fluorescence compatibles, soit par les technologies BRET (récepteurs marqués avec RLuc8 et Venus) et NanoBiT (récepteurs marqués avec des fragments SmBit et LgBit de la NanoLuciferase) (Ciolek et al., 2017; Reynaud et al., 2020).
.
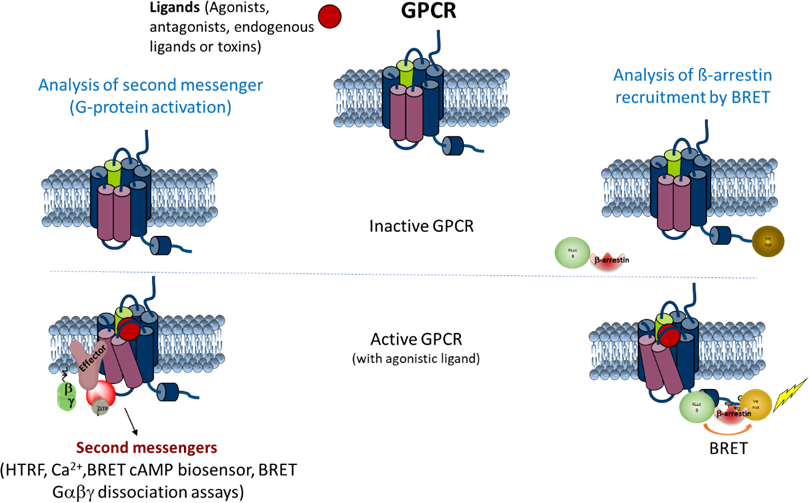
Caractérisation fonctionnelle des interactions entre les ligands et les GPCRs (récepteurs couplés aux protéines G).