Cette méthode est basée sur le suivi quantitatif d'un grand nombre de peptides (22 au total) distribués uniformément le long de la séquence de la protéine tau. Leur abondance relative, par rapport à une protéine tau recombinante, renseigne sur l'hétérogénéité et la proportion des formes endogènes (ou protéoformes) présentes dans le liquide céphalo-rachidien humain (LCR).
L'approche inclut une préparation simple de l'échantillon biologique, par précipitation acide suivie d'une extraction sur phase solide, développée pour isoler l'ensemble des différentes protéoformes. La détection par spectrométrie de masse est réalisée sur un appareil à haute résolution et permet le suivi simultané de 22 peptides spécifiques issus de la protéine. Dans des échantillons de LCR humain, les abondances de ces 22 peptides sont comparées à une protéine tau recombinante pour illustrer la proportion des protéoformes endogènes. L'équipe du SPI a ainsi montré une sur-représentation des peptides centraux, correspondant à une forme tronquée de ~17 kDa, ainsi que ceux des isoformes 1N/3R (Figure).
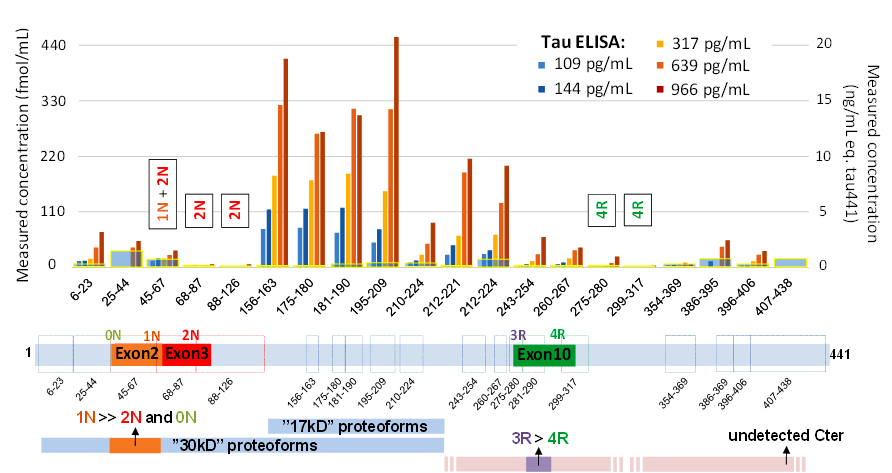
Figure: Abondance relative des 22
peptides suivis par spectrométrie de masse pour 5 échantillons de LCR humain; correspondance avec les principales
protéoformes connues de tau.
En perspective, l'objectif sera de renforcer encore les performances de l'approche pour couvrir un plus grand nombre de protéoformes, notamment les formes phosphorylées, et affiner leur caractérisation. Les nouvelles données ainsi obtenues, complémentaires aux techniques Elisa ou Western Blot, seront très certainement utiles pour le diagnostic et/ou la compréhension de la physiopathologie des tauopathies.