Les protéines collectrices de lumière des plantes supérieures (LHCII) interviennent au cours des premières étapes de la conversion de l'énergie lumineuse, dans la photosynthèse. Ce sont des macromolécules complexes, composées de trois sous-unités liant chacune quatorze chlorophylles et quatre molécules de caroténoïdes. Un des problèmes essentiels pour comprendre précisément les cascades de transfert dans ces protéines est qu'il est extrêmement difficile de produire des mutants ponctuels de ces protéines. Une approche alternative consiste à reconstituer ces protéines, à partir d'apoprotéines modifiées produites dans Escherichia coli et du mélange approprié de leurs différents cofacteurs. Cependant, une telle entreprise est doublement complexe. D'une part chaque cofacteur doit trouver sa place, d'autre part, les sous-unités doivent s'associer correctement pour former une protéine native (trimère).
Dans ce travail, la reconstitution de la protéine LHCII a été réalisée à partir d'apoprotéines sauvages et portant deux mutations au site de la sérine 123, qui correspond à une courte boucle entre deux hélices transmembranaires. L'ensemble de ces protéines se présente sous une forme trimérique, correctement repliée. Le remplacement de la sérine 123 par une glycine n'affecte ni les fonctions, ni la structure fine de la protéine. L'introduction d'une proline à ce site induit une contrainte qui se traduit par une variation de la conformation d'un des caroténoïdes lié aux LHCII, le caroténoïde néoxanthine, qui adopte une conformation plus distordue, et dont l'absorption se déplace vers le bleu. Par ailleurs, cette mutation induit la perte d'une liaison hydrogène entre le carbonyle conjugué d'une des chlorophylles liée à la protéine, sans cependant affecter les propriétés d'absorption de cette dernière. Ces résultats montrent qu'on peut reconstituer les LHCII, même avec des apoprotéines portant des mutations, en conservant l'intégrité structurale de la protéine native. Par ailleurs, ils mettent en évidence que les propriétés électroniques des chlorophylles a dépendent peu des liaisons hydrogène que ces pigments engagent avec la protéine au niveau de leurs carbonyles conjugués.
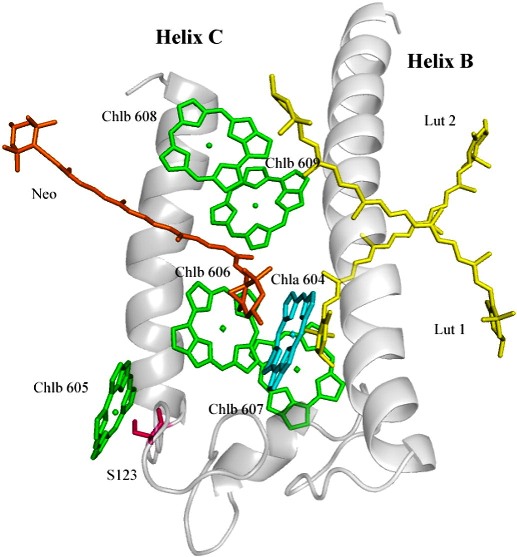
Modèle structural plausible de LHCII reconstitué