REsponsable : REsponsable :
Bernard Maillère
01 69 08 94 47 bernard.maillere@cea.fr | Immunogénicité des protéines et anticorps thérapeutiques (B. Maillère) Ingénierie d'Anticorps et Immunogénicité (H. Nozach) Biologie de Synthèse et Évolution (O. Ramos)
|
Le système immunitaire est fait de réseaux complexes d'interactions entre des protéines secrétées ou des protéines exprimées à la surface des cellules. Ces protéines sont codées par des gènes de la lignée germinale ou résultent, pour les immunoglobulines et les récepteurs T, de recombinaisons aléatoires de plusieurs gènes qui créent un répertoire de molécules variées et capables d'interactions sélectives. Ce répertoire est composé chez l'homme de plusieurs centaines de millions de clones différents qui sont en partie sélectionnés pour interagir de préférence avec des molécules qui nous sont étrangères (le non-soi) et éviter les réactions avec nos propres molécules (le soi). Toutefois, cette sélection est très imparfaite en raison de la complexité de la représentation moléculaire du soi. Les mécanismes que nous étudions sont en grande partie une conséquence de la composition des répertoires immuns et les systèmes d'évolution dirigés que nous utilisons sont essentiellement inspirés du système immunitaire.
IMMUNOGÉNICITÉ DES PROTÉINES ET ANTICORPS THÉRAPEUTIQUES
|
Responsable
Bernard Maillère
01 69 08 94 47
|
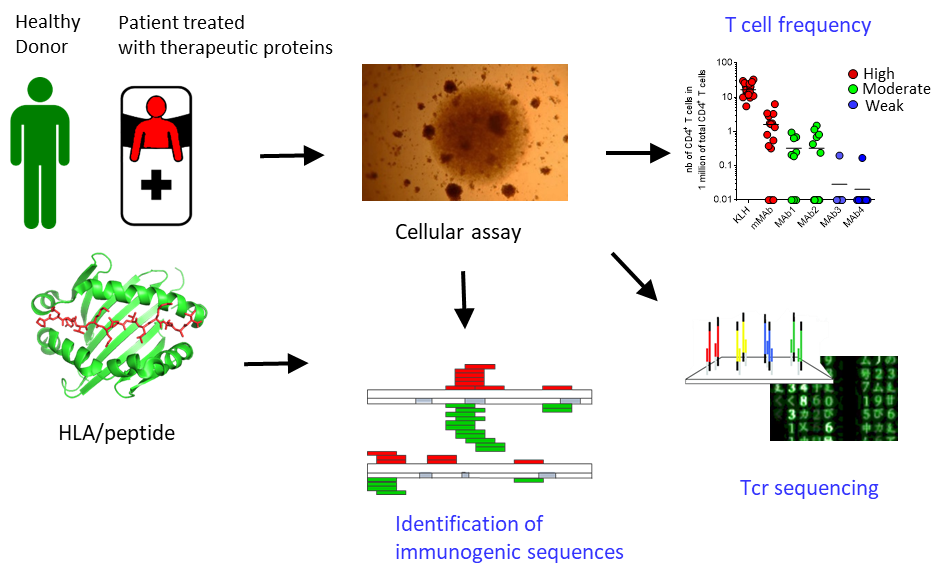
Les protéines et anticorps thérapeutiques représentent une part toujours croissante des médicaments. Parmi les dix molécules les plus vendues au monde, huit sont des anticorps. Ces molécules présentent l'avantage d'être très spécifiques de leur cible et peu toxiques. En revanche, elles présentent l'inconvénient d'être potentiellement immunogènes c'est à dire de déclencher une réponse immunitaire. Les anticorps que peuvent produire les patients et qui sont dirigés contre une protéine thérapeutique, peuvent diminuer ou augmenter la pharmacocinétique de la protéine, neutraliser son activité thérapeutique ou déclencher des symptômes allergiques ou autoimmuns. En raison du rôle majeur des lymphocytes T CD4 dans le déclenchement et la régulation de la réponse immunitaire, la quantification du répertoire de lymphocytes T CD4 naïfs spécifiques de molécules thérapeutiques et l'identification des séquences que reconnaissent ces cellules (épitopes T) nous permet de mieux comprendre l'origine de l'immunogénicité des molécules thérapeutiques.
En identifiant les épitopes de plusieurs anticorps thérapeutiques, nous avons montré que les épitopes T des anticorps thérapeutiques étaient présents dans les parties mutées des séquences variables (1-3). Nous avons également mis en évidence l'existence de lymphocytes T CD4 spécifiques des protéines faiblement exprimées dans le corps comme les hormones et les facteurs de croissance et de remplacement qui expliquent l'immunogénicité de leur forme recombinante (4-7). Les travaux en cours portent sur la caractérisation de la clonalité des répertoires spécifiques de protéines thérapeutiques, le phénotype effecteur ou régulateur des lymphocytes T CD4 spécifiques de protéines thérapeutiques ainsi que sur le développement d'une stratégie pour créer des molécules dé-immunisées c'est-à-dire n'induisant plus de réponse immunitaire.
INGÉNIERIE D'ANTICORPS ET IMMUNOGÉNICITÉ
L'équipe Ingénierie d'Anticorps et Immunogénicité du DMTS/SIMoS développe de nouveaux ligands à base d'anticorps pour différentes applications, aussi bien thérapeutiques, pour l'imagerie ou diagnostiques. Elle s'intéresse particulièrement à concevoir des anticorps de haute affinité avec une sélectivité contrôlée mais également peu immunogènes pour une permettre une administration chez l'homme en limitant les risques d'immunogénicité.
L'équipe a développé des outils d'ingénierie moléculaire des protéines couplant une méthode de criblage à haut-débit, le Yeast Surface Display, avec des méthodes de séquençage NGS à haut-débit (8). Elle met notamment en œuvre une approche de Deep Mutational Scanning visant à identifier dans la séquence des protéines les principaux acides aminés ayant un rôle fonctionnel pour la propriété recherchée. Les données de DMS permettent notamment à comprendre les interfaces protéine/protéines (comme les épitopes ou les paratopes) (9, 10). Celles-ci servent également pour guider l'ingénierie de molécules optimisées, notamment pour la maturation d'affinité ou l'ingénierie de la sélectivité des anticorps.
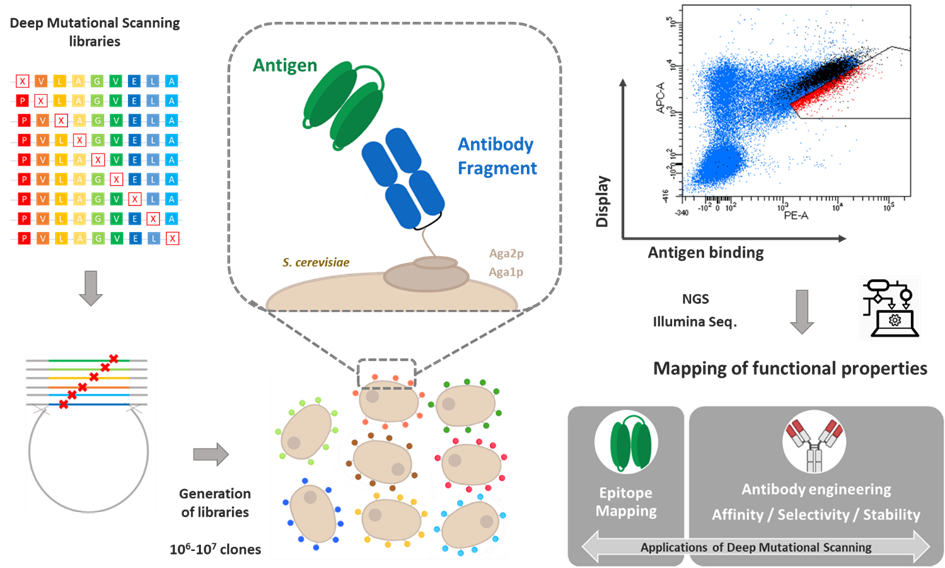
Ces technologies sont à l'origine de la création de la société de service en ingénierie d'anticorps Deeptope :
http://deeptope.com

BIOLOGIE DE SYNTHÈSE ET ÉVOLUTION
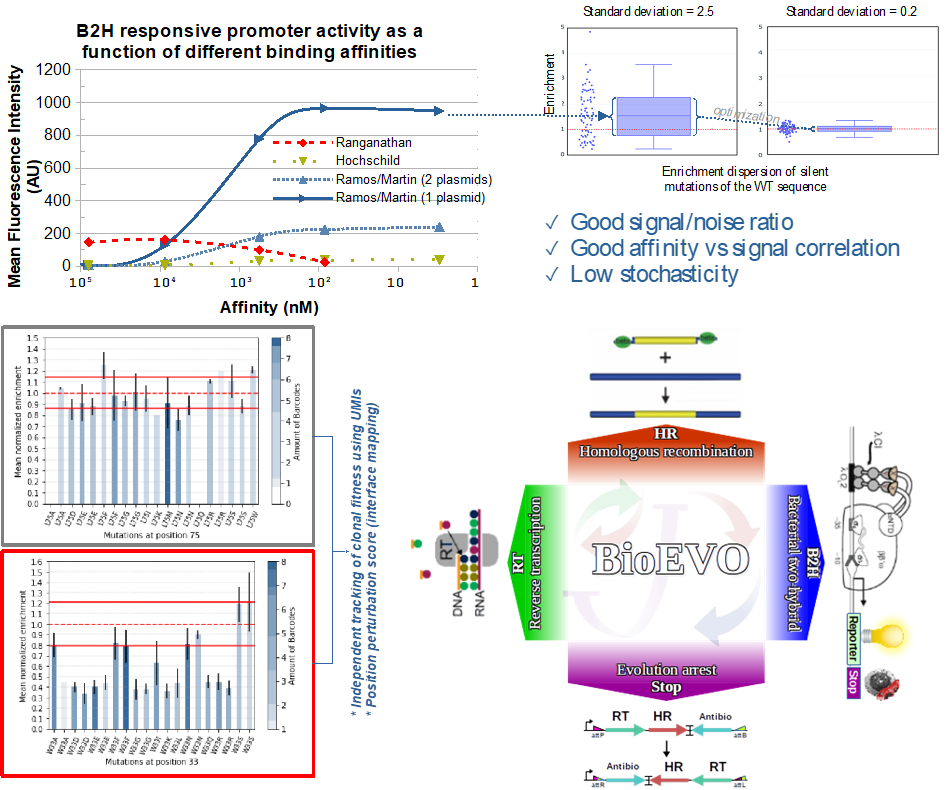
L'équipe de Biologie de Synthèse et Évolution (SBE) s'intéresse à l'évolution moléculaire et la biologie de synthèse. Notre boîte à outils comprend de nombreuses technologies de biologie moléculaire, dont une partie a été développée par l'équipe elle-même. Les principales applications concernent le domaine de l'assemblage d'ADN, d'ingénierie génomique microbienne et d'évaluation d'interactions moléculaires dans le contexte intracellulaire et d'évolution continue. Une technologie centrale dans nos activités est un système de double-hybride bactérien quantitatif à faible stochasticité, ayant une bonne gamme dynamique et une bonne corrélation avec l'affinité. Cette technologie, mise au point par notre équipe, s'applique également dans le développement d'un système d'évolution continue inspiré des rétrovirus tel que le VIH (brevet EP20305531).