Le Lanréotide est un octapeptide di-cationique analogue synthétique et thérapeutique d’une hormone naturelle la somatostatine. Ce peptide s’auto-assemble spontanément dans l’eau et forme des nanotubes creux de diamètre parfaitement bien défini de 24.4nm et de longueur atteignant le millimètre. La paroi de ces nanotubes de 2.6nm d’épaisseur est formée par une bicouche de peptide. La brique unitaire de cet édifice supramoléculaire est un dimère face contre face dont l’empilement dans une direction est stabilisé par des réseaux de liaisons hydrogène en feuillet beta antiparallèle définissant ainsi un filament. Dans l’autre direction l’assemblage des filaments est effectué par des interactions entre résidus aromatiques. Il faut exactement 26 filaments pour former un nanotube de 24.4nm de diamètre.
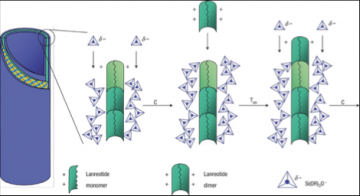
Mécanisme de formation des nanotubes de lanreotide
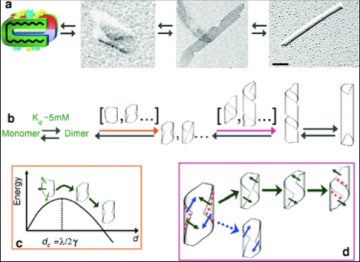
En dessous de sa concentration critique d’assemblage, le lanréotide est en équilibre entre deux formes, monomères et dimères. Le dimère est la brique d’assemblage qui fixe l’épaisseur de la paroi du nanotube. Par un processus de nucléation classique, les dimères de peptide s’auto assemblent en un cristal bidimensionnel courbe fixant ainsi le diamètre final du nanotube. Lorsque ce cristal bidimensionnel courbe est proche de la fermeture, les fortes répulsions électrostatiques provenant des deux charges positives du peptide ralentissent certaines des vitesses de croissance du cristal par rapport à d’autres provoquant ainsi l’apparition d’un intermédiaire transitoire et instable, un ruban hélicoïdal. La fermeture de ce ruban fait apparaitre les nanotubes finaux.
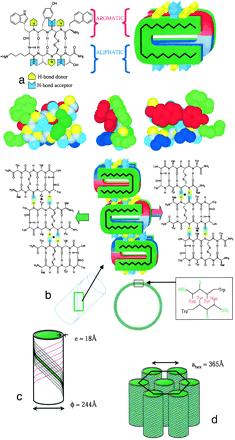
De la molécule au contrôle de la taille des assemblages
La connaissance de la structure des nanotubes de Lanreotide nous permet de réfléchir à la façon de moduler le diamètre des nanotubes tout en gardant le mode d’empilement du peptide. Nous savons que le diamètre des nanotubes est fixé très tôt lors de l’assemblage. Nous avons pensé que la géométrie de l’interaction médiée par des interactions entre aromatiques en particulier était primordial pour fixer le rayon de courbure des cristaux bidimensionnel, donc le diamètre des nanotubes finaux. Nous avons bâti un modèle géométrique reposant sur l’encombrement stérique des close contacts entre filaments et vérifier ce modèle en changeant chimiquement un des résidus aromatiques dans la séquence peptidtique effectuant le close contact. Nous obtenons ainsi des nanotubes toujours monodisperses en diamètre mais dont nous contrôlons le diamètre entre 10 et 35 nm.
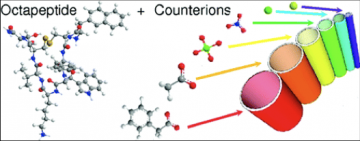
Influence des contre-ions sur l’auto-assemblage de peptide
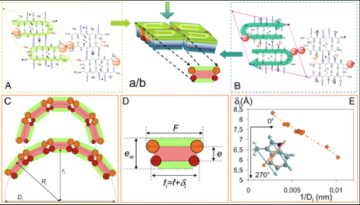
Le Lanréotide est un octapeptide di-cationique. Une question restant non résolue sur ce système était comment et pourquoi ce peptide pouvait s’assembler en contrecarrant les forces électrostatiques fortement répulsives. Nous avons donc réalisé une étude axée sur le comportement des conterions sur ce système puisqu’eux seuls pouvaient jouer le rôle d’écrantage des forces de répulsion. Nous avons ainsi observé que si le monomère de Lanréotide en solution était totalement dissocié de ses contreions alors que sur le dimère 3 des 4 contreions n’étaient pas dissociés. Ceci signifie que la charge apparente du dimère est inférieure à celle du monomère expliquant ainsi que le dimère est la brique unitaire de l’assemblage. Plus de 90% des contreions sont condensés sur les nanotubes, bien plus que la théorie ne le prévoit. Ceci diminue fortement la densité de charge des parois de nanotubes et suppose une interaction conterions peptide spécifique. En changeant la nature et la taille des contreions (dans la série de Hofmeister) nous observons que le diamètre final des nanotubes dépend du conterions que nous pouvons ainsi moduler entre 19 et 26nm, démontrant ainsi que les contreions sont insérés dans les parois des nanotubes. Par des expériences de compétition entre conterions, nous avons montrés que les sites de fixation spécifiques des contreions se trouvent sur la paroi interne des nanotubes.
Utilisation des nanotubes de lanréotide comme moules pour former des nanotubes de verre à double paroie.
Dans ce travail, les nanotubes de Lanréotide sont utilisés pour réaliser un matériau composite peptide-silice. Le résultat de la minéralisation des nanotubes de peptide montre que les parois internes et externes des nanotubes sont tapissées par une couche de silice d’épaisseur bien définie (1.4 nm). Ce résultat est dû au fait que les nanotubes de peptide croissent en même temps que la silice se condense sur les parois chargées des nanotubes de peptide par un mécanisme synergique entre les deux processus. L’épaisseur de la couche de silice est reliée à la densité de charge des parois des nanotubes qui provoque une augmentation très forte de la concentration des précurseurs de silice chargé négativement à proximité des parois.